Ejemplo de Enlace Covalente
El Enlace Covalente es aquel en que dos átomos se unen compartiendo sus electrones, para ir completando sus Reglas del Octeto.
Contenido del artículo
Historia del Enlace Covalente
Fue a principios del siglo XX que los químicos empezaron a comprender cómo y porqué se formaban las moléculas. El primer avance importante surgió con la proposición de Gilbert Lewis de que la formación de un enlace químico implica que los átomos compartan electrones. Lewis describió la formación de un enlace químico en el Hidrógeno como:
![]()
Este tipo de apareamiento de electrones es un ejemplo de Enlace Covalente, un enlace en que dos electrones son compartidos por dos átomos. Los Compuestos Covalentes son aquellos que sólo contienen enlaces covalentes.
Los Electrones en el Enlace Covalente
Para simplificar, el par de electrones compartidos se representa a menudo como una sola línea que conecta los símbolos de los elementos. Así, el enlace covalente de la molécula de Hidrógeno se escribe como H-H.
En el enlace covalente, cada electrón del par compartido es atraído por los núcleos de ambos átomos. Esta atracción mantiene unidos a los dos átomos en la molécula de H2 y es la responsable de la formación de enlaces covalentes en otras moléculas.
En los enlaces covalentes entre átomos de varios electrones sólo participan los electrones de valencia, que son los más externos, en el orbital más superficial. Participarán entre uno y tres de ellos en la unión.
A los demás electrones, que no participan en el enlace, se les llama Electrones No Enlazantes, o si los organizamos por pares, Pares Libres. Es decir, pares de Electrones de Valencia que no participan en la Formación del Enlace Covalente.
Representación del Enlace Covalente
Las estructuras con las que se representan los compuestos covalentes, como H2 y F2 se conocen como estructuras de Lewis. Una estructura de Lewis es una representación de un enlace covalente, donde el par de electrones compartidos se indica con líneas o como pares de puntos entre dos átomos, y los pares libres no compartidos se indican como pares de puntos en los átomos individuales. En una estructura de Lewis sólo se muestran los electrones de valencia, y no los internos.
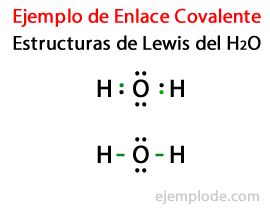
Considerando la estructura de Lewis para la molécula de Agua H2O, se señala primero con puntos todos los electrones de valencia de los átomos de Hidrógeno y de Oxigeno.
En un segundo caso, se señala con una línea el enlace. Y los pares libres, que existirán sólo en el Oxígeno, con puntos.
La Regla del Octeto
La formación de estas moléculas, como las del Agua H2O, ilustra la llamada Regla del Octeto, propuesta por Lewis: Un átomo diferente del Hidrógeno tiende a formar enlaces hasta que se rodea de ocho electrones de valencia, es decir, se forma un enlace covalente cuando no hay suficientes electrones para que cada átomo individual complete su octeto.
Al compartir electrones en un enlace covalente, cada átomo completa su octeto. Para el Hidrógeno, el requisito es que obtenga la configuración electrónica del Helio, que es tener un total de dos electrones.
La regla del octeto funciona principalmente para los elementos del segundo periodo o renglón de la tabla periódica. Estos elementos tienen subniveles en los que puede haber un total de ocho electrones.
Cuando un átomo de estos elementos forma un Compuesto Covalente, obtiene la configuración electrónica del Gas Noble Neón, compartiendo electrones con otros átomos en el mismo compuesto.
Tipos de Enlaces Covalentes
Los átomos pueden formar distintos tipos de Enlaces Covalentes: Sencillos, Dobles o Triples.
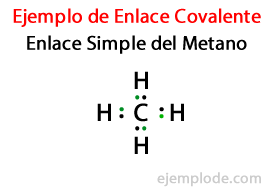
En un Enlace Sencillo, dos átomos se unen por medio de Un Par de Electrones. Suceden en la gran mayoría de los compuestos Covalentes, y es la forma más básica de este enlace.
En muchos compuestos se forman Enlaces Dobles, es decir, cuando dos átomos comparten Dos Pares de Electrones. Si dos átomos comparten Dos Pares de Electrones, el enlace Covalente se denomina Enlace Doble. Estos enlaces se encuentran en moléculas como Dióxido de Carbono (CO2) y Etileno (C2H4).

Un Enlace Triple surge cuando dos átomos comparten Tres Pares de Electrones, como en la molécula de Nitrógeno N2, la molécula de Acetileno C2H2.

Los enlaces múltiples son más cortos que los enlaces covalentes sencillos. La Longitud de enlace se define como la distancia entre el núcleo de dos átomos unidos por un enlace covalente en una molécula.
Diferencias entre Compuestos Covalentes y Iónicos
Los compuestos iónicos y covalentes presentan marcadas diferencias en sus propiedades físicas generales, debido a que sus enlaces son de distinta naturaleza.
En los Compuestos Covalentes existen dos tipos de fuerzas de atracción; una de ellas es la que mantiene unidos a los átomos de una molécula. Una medida cuantitativa de esta atracción es la energía de enlace. La otra fuerza de atracción opera entre las moléculas completas, y se llama Fuerza Intermolecular. Como las Fuerzas Intermoleculares suelen ser más débiles que las fuerzas que mantienen unidos a los átomos de una molécula, las moléculas de un compuesto covalente se unen con menos fuerza.
En consecuencia, los compuestos covalentes casi siempre son gases, líquidos o sólidos de bajo punto de fusión. Por otro lado, las fuerzas electrostáticas que mantienen unidos a los iones en un compuesto iónico por lo común son muy fuertes, de modo que los compuestos iónicos son sólidos a temperatura ambiente y tienen puntos de fusión elevados. Muchos compuestos iónicos son solubles en agua, y sus disoluciones acuosas conducen la electricidad debido a que estos compuestos son electrólitos fuertes.
La mayoría de los compuestos covalentes son insolubles en agua, y si se llegan a disolver, sus disoluciones acuosas por lo general no conducen electricidad porque estos compuestos son no electrólitos. Los compuestos iónicos fundidos conducen electricidad porque contienen cationes y aniones que se mueven libremente; los compuestos covalentes líquidos o fundidos no conducen electricidad porque no hay iones presentes.
Ejemplos de Compuestos con Enlace Covalente
- Acetileno C2H2
- Metano CH4
- Etano C2H6
- Propano C3H8
- Butano C4H10
- Benceno C6H6
- Tolueno C7H8
- Alcohol Metílico CH3OH
- Alcohol Etílico C2H5OH
- Alcohol Propílico C3H7OH
- Éter Metílico CH3OCH3
- Éter MetilEtílico C2H5OCH3
- Éter Etílico C2H5OC2H5
- Ácido Fórmico HCOOH
- Ácido Acético CH3COOH
- Ácido Propiónico C2H5COOH
- Ácido Butírico C3H7COOH
- Dióxido de Carbono CO2
- Monóxido de Carbono CO
- Nitrógeno molecular N2
- Hidrógeno molecular H2
¿Cómo citar? Contreras, V. & Del Moral, M. (s.f.). Ejemplo de Enlace Covalente.Ejemplo de. Recuperado el 26 de Septiembre de 2023 de https://www.ejemplode.com/38-quimica/4707-ejemplo_de_enlace_covalente.html

Últimos 10 comentarios